华东理工大学「国家高层次青年人才」陈宜峰最新Angew | 内烯烃的对映选择性四组分羰基化双碳官能团化反应!
- 2026-01-29 23:37:45
华东理工大学「国家高层次青年人才」陈宜峰最新Angew | 内烯烃的对映选择性四组分羰基化双碳官能团化反应!
过渡金属催化羰基化反应以CO为C1原料,是工业/精细化学合成中制备羰基化合物的基础方法。尽管手性羰基结构单元在生物活性分子中普遍存在,但温和条件下催化不对称羰基化的通用方法仍较为稀缺,这受限于立体控制挑战和竞争路径。现有方法通常依赖多步序列或限制性分子内策略。 
在本文中,作者报道了1大气压CO下钯(Pd)催化内烯烃、芳基重氮盐和亲核试剂的分子间四组分羰基化双碳官能团化反应。该方法可同时控制区域、非对映和对映选择性,高效构建无环手性羰基骨架中的拥挤相邻立体中心。亲核试剂的模块性使多种对映体富集的酯或酮以高产率和高立体选择性获得。温和条件可防止手性羰基的外消旋化,衍生化反应凸显了广泛的合成实用性。 羰基化反应以一氧化碳(CO)为通用C1原料构建含羰基有机分子,是化学领域最具变革性的方法之一。它们构成了重要工业过程的基础,深刻影响日常生活,典型例子包括乙烯氢甲酰化制备醛和甲醇羰基化生产乙酸。在有机合成化学中,羰基化对于发现逆合成分析中的新策略性切断同样不可或缺,如Pauson-Khand反应在复杂分子合成中的应用。手性羰基结构单元(醛、酮、羧酸及其衍生物)在药物、农药和材料中的基本重要性,为推进催化不对称羰基化方法提供了令人信服的持久动力。 尽管过渡金属催化烯烃的氢羰基化反应通常在升高的CO压力下进行,且通常由金属氢化物的迁移插入引发,可高效制备含单一立体中心的手性羰基化合物(代表性例子包括铑催化烯烃的不对称氢甲酰化和钯催化烯烃的氢羧化),但能够对映选择性构建含多个立体中心羰基骨架的直接一步策略仍极为罕见。现有制备此类复杂结构单元的方法通常需要多步序列,或存在模块性有限的问题。因此,开发通用的催化不对称羰基化方法,能够高效且模块化地安装羰基基团并对多个中心进行精确立体控制,是一个重要但具有挑战性的目标。 不对称多组分反应(AMCRs)是有机合成中的强大范式,能够从三种或更多易得原料中一步直接、汇聚式组装具有高多样性的手性分子复杂性。这种内在效率使AMCRs成为开发新型不对称羰基化模式的有吸引力平台。本文致力于开发钯催化的四组分羰基化双碳官能团化反应,协同整合芳基亲电试剂、亲核试剂、烯烃和CO气体。关键的是,该方法体现了独特的反应机理:关键的立体选择性迁移插入通过金属-碳键(芳基-钯到烷基-钯)进行,与经典的由金属氢化物插入引发的氢羰基化途径(如钯-氢到烷基-钯)存在根本差异。这种新型C―M键插入途径有望直接构建含拥挤相邻立体中心的手性羰基化合物,该结构单元通过现有方法难以对映选择性获得。 然而,实现这种四组分多组分反应面临持续的机理和选择性障碍: 由于上述挑战,Pd(0)催化内烯烃的不对称分子间四组分交叉偶联反应基本未被探索。现有不对称羰基化方法多依赖分子内策略(通过烯烃与亲电/亲核试剂的tethering实现环化),虽适用于环状骨架,但范围受限。作者报道了1大气压CO下内烯烃的分子间不对称四组分羰基化交叉偶联反应,直接解决了这些局限性:使用芳基重氮亲电试剂避免强碱,消除外消旋化;新合成的手性双恶唑啉配体实现区域、非对映和对映选择性的同步控制,在拥挤相邻立体中心实现卓越立体区分;亲核试剂的模块性使α-手性酯(三氟乙醇)和含双立体元素的酮(芳基硼酸)的发散合成为可能;产物衍生化为有价值化合物进一步证明了合成实用性。 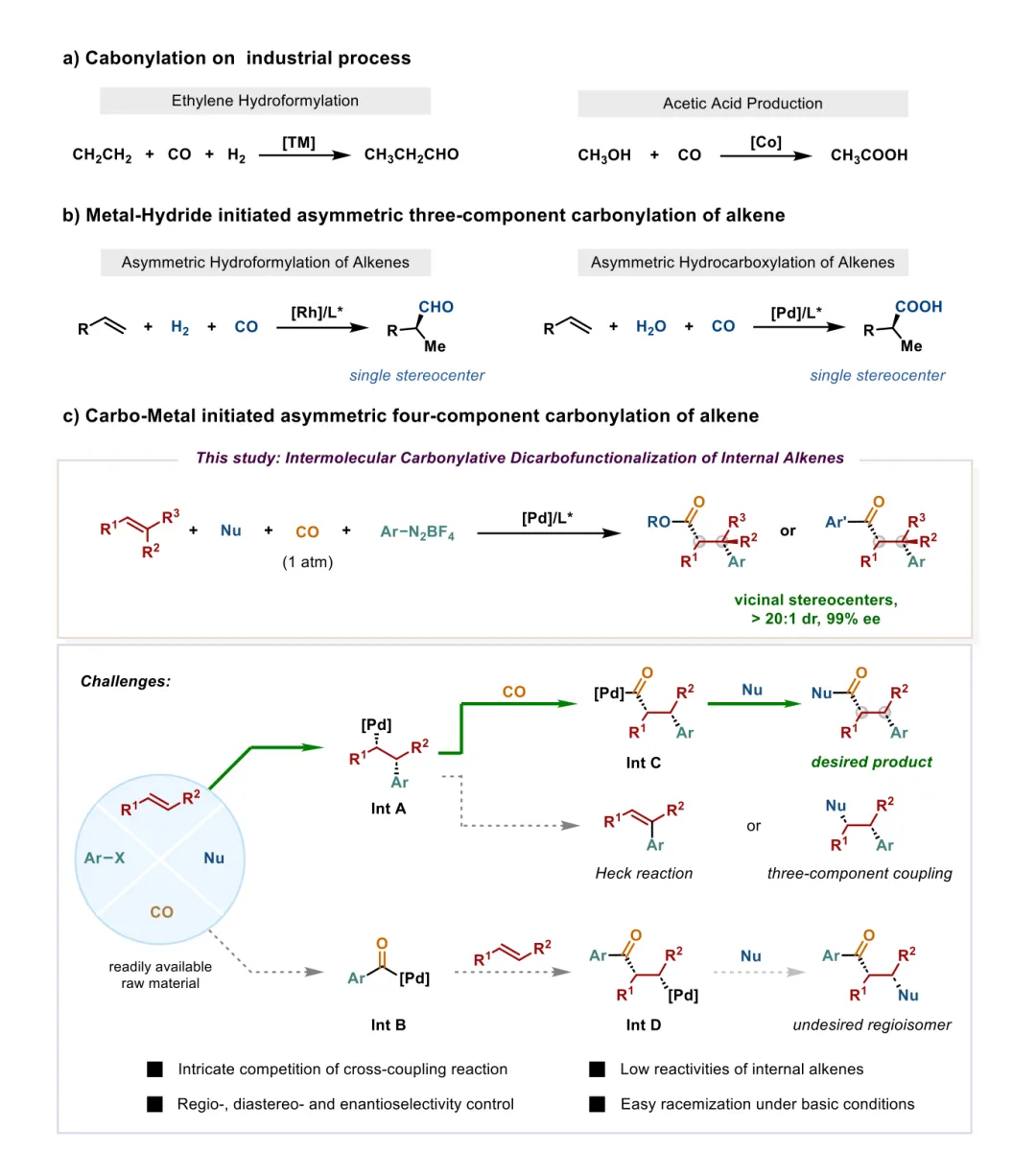
图1 过渡金属催化不对称羰基化反应概述。(a) 工业应用中的代表性羰基化反应。(b) 金属氢化物物种立体选择性迁移插入引发的过渡金属催化末端烯烃不对称三组分羰基化反应。(c) 1大气压CO下钯催化芳基亲电试剂、亲核试剂与内烯烃的不对称分子间四组分羰基化交叉偶联反应。 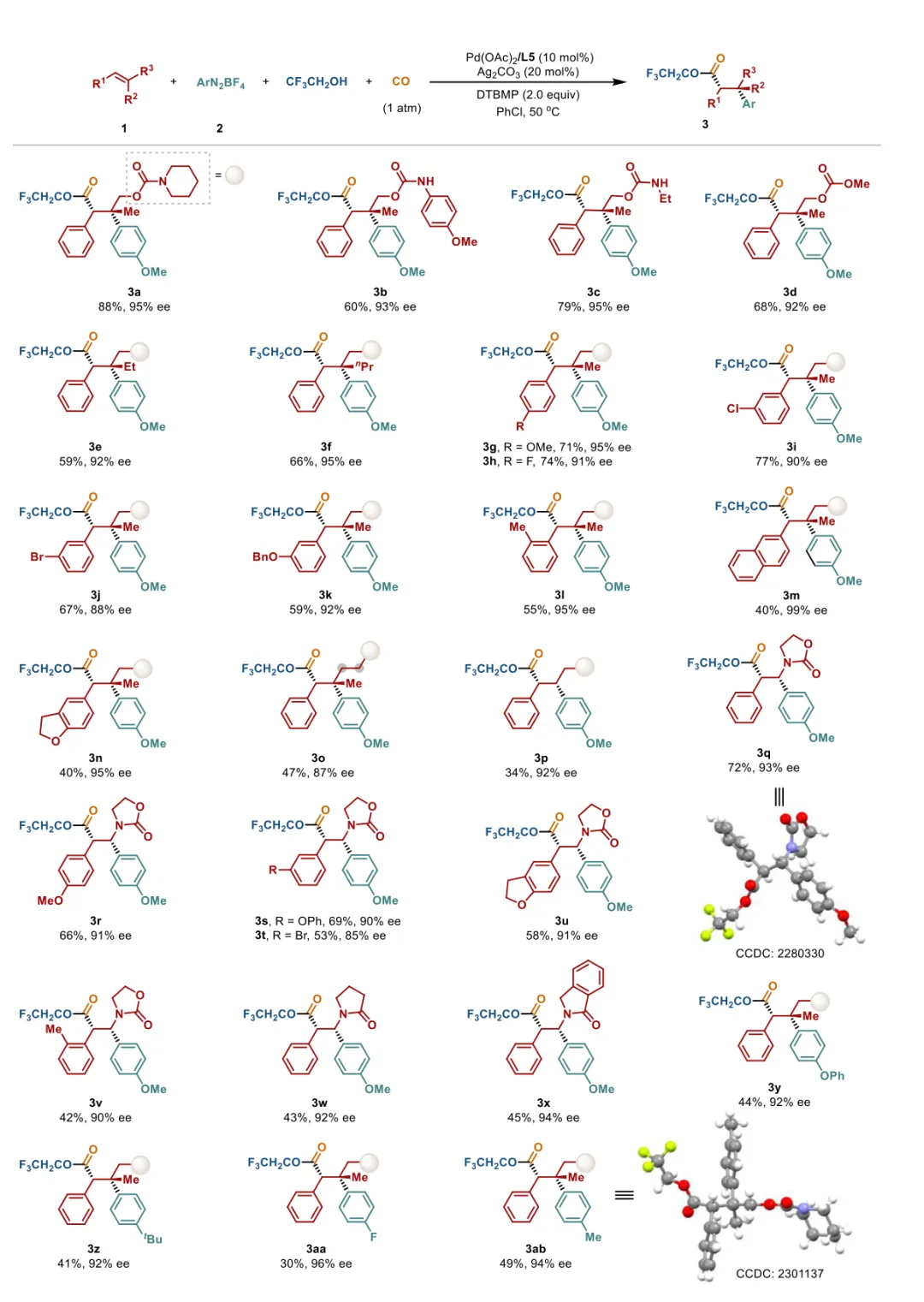
图2 三氟乙醇参与的不对称羰基化反应底物范围。反应条件:1(1.0当量)、2(3.0当量)、Pd(OAc)₂(10 mol%)、L5(10 mol%)、DTBMP(2.0当量)和Ag₂CO₃(20 mol%)在CF₃CH₂OH/PhCl(体积比=3/1,0.5 M)中、50℃、CO氛围(1.0 atm)下反应。报道分离产率,对映体过量(ee)通过手性高效液相色谱(HPLC)分析确定。 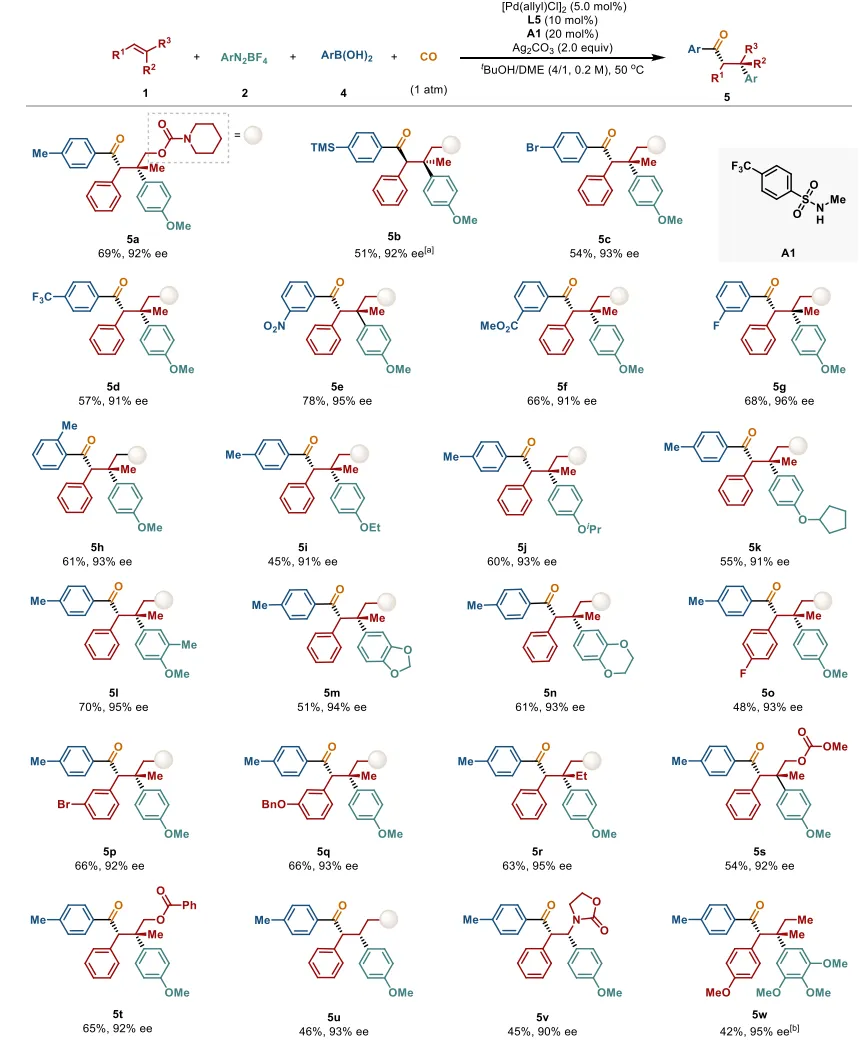
图3 钯催化烯烃与芳基硼酸的不对称羰基化反应底物范围。反应条件:烯烃(1.0当量)、芳基重氮盐(3.0当量)、芳基硼酸(4.0当量)、[Pd(allyl)Cl]₂(5.0 mol%)、L5(10 mol%)和A1(N-甲基-4-(三氟甲基)苯磺酰胺,20 mol%)、Ag₂CO₃(2.0当量)在tBuOH/DME(体积比=4/1,0.2 M)中、50℃、CO氛围(1.0 atm)下反应。报道分离产率,对映体过量(ee)通过手性高效液相色谱(HPLC)分析确定。(a) 用L4代替L5,A1为1.0当量。(b) [Pd(allyl)Cl]₂(10 mol%),L5(30 mol%)。 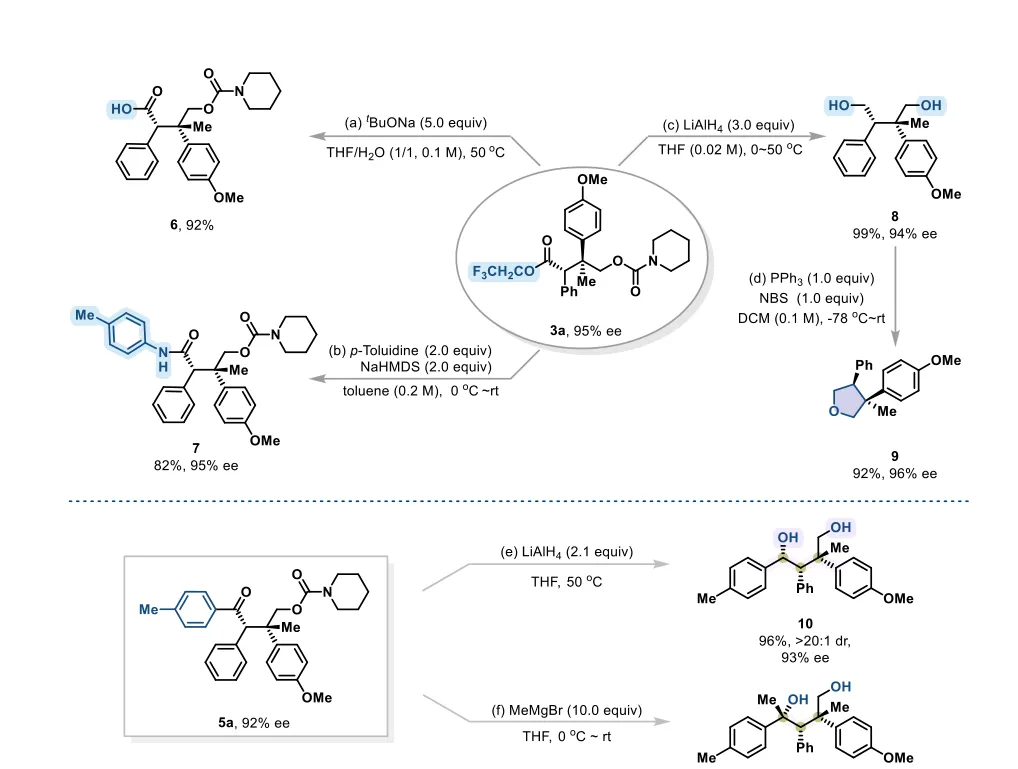
图4 合成应用。反应条件:(a) tBuONa(5.0当量),THF/H₂O(体积比=1/1,0.1 M),50℃;(b) p-甲苯胺(2.0当量),NaHMDS(2.0当量),甲苯(0.2 M),0℃至室温;(c) LiAlH₄(3.0当量),THF(0.02 M),0至50℃;(d) PPh₃(1.0当量),NBS(1.0当量),二氯甲烷(DCM,0.1 M),-78℃至室温;(e) LiAlH₄(2.1当量),THF(0.05 M),0至50℃;(f) MeMgBr(10.0当量),THF(0.1 M),0℃至室温。 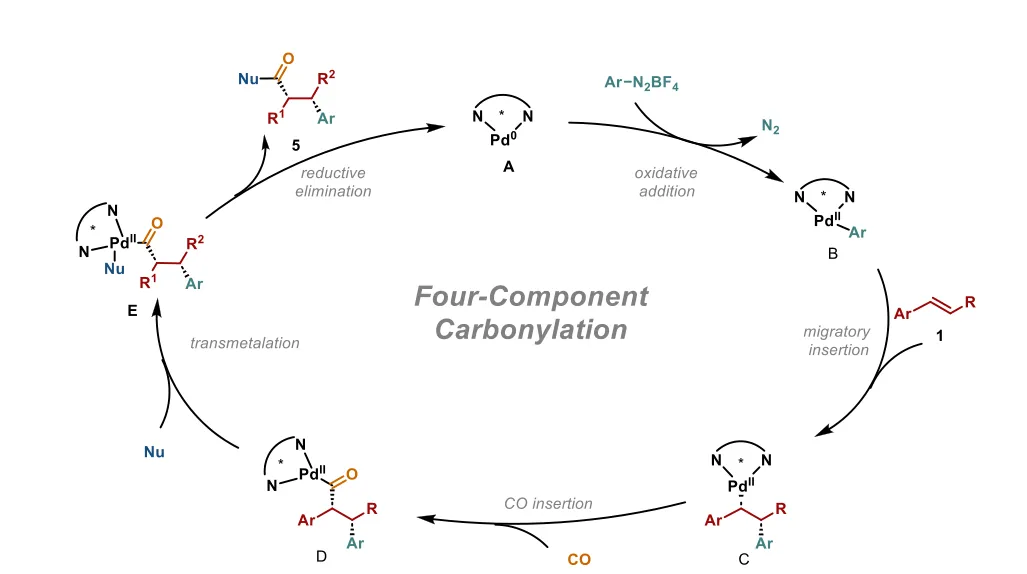
图5 提出的反应机理。 综上,作者报道了1大气压CO下钯催化内烯烃的不对称分子间四组分羰基化双碳官能团化反应。该一锅法能够高效构建一系列含相邻季-叔立体中心或叔-叔立体中心的光学纯酯和酮,具有高化学、区域、非对映和对映选择性,以及优异的官能团耐受性。所得羰基化合物的进一步合成转化凸显了该方法的潜在实用性。作者预计,这种钯催化对映选择性多组分反应将激发更多关于含多立体中心复杂结构合成的研究。 

2026年1月28日,华东理工大学陈宜峰在国际知名期刊Angewandte Chemie International Edition发表题为《Palladium-Catalyzed Enantioselective Four-Component Carbonylative Dicarbofunctionalization of Internal Alkenes With 1 Atm CO》的研究论文,YangXi为论文第一作者,陈宜峰为论文共同通讯作者。

基元步骤竞争:芳基-钯(II)中间体遭遇烯烃与CO的发散配位,导致生产性1,2-迁移插入(生成烷基-钯(II)中间体A)或非生产性1,1-插入(生成酰基-钯(II)中间体B)。烷基-钯(II)物种A虽理论上可羰基化生成酰基中间体C,但易发生β-氢消除生成Heck型副产物;其与亲核试剂的直接转金属化则生成不含CO的三组分加合物。酰基-钯(II)中间体B易发生非生产性烯烃插入生成中间体D,后续转金属化会形成区域异构体。 羰基产物外消旋化:常规交叉偶联在碱性条件下进行,羰基产物易通过弱酸性α-C–H位点去质子化发生外消旋化。 内烯烃反应性低:内烯烃对钯催化剂反应性低,通常无法参与反应,仅能实现芳基亲电试剂、亲核试剂与CO的三组分偶联。 立体选择性控制难:需开发强大的手性钯催化剂,同时控制区域、化学、对映和非对映选择性。





Palladium-Catalyzed Enantioselective Four-Component Carbonylative Dicarbofunctionalization of Internal Alkenes With 1 Atm CO. Angew. Chem. Int. Ed.,2026. https://doi.org/10.1002/anie.6399534.
#华东理工大学#陈宜峰#催化#Angew#钯催化内烯烃#不对称分子

本文来自网友投稿或网络内容,如有侵犯您的权益请联系我们删除,联系邮箱:wyl860211@qq.com 。
