上海交通大学国家优青携手国家级领军人才和院长Nat Catal-合成生物学
- 2026-01-25 06:44:29
一、中文标题
中心代谢物丙二酰辅酶A及其衍生物的高效合成:一种非羧化途径(A non-carboxylative route for the efficient synthesis of central metabolite malonyl-CoA and its derived products)
(点击页面左下角阅读原文,直达文献页面)
二、发表单位及通讯作者
发表单位:上海交通大学、武汉大学、中国科学院、山东大学、南佛罗里达大学等
通讯作者:Chen Yang、Tiangang Liu、Zaigao Tan
三、科学问题
如何克服天然乙酰辅酶A羧化途径合成丙二酰辅酶A时存在的动力学缓慢、碳效率低、调控严格、结构复杂等问题,开发一种高效、调控简单、结构精简的人工合成途径,以提升丙二酰辅酶A及其衍生物的生物合成效率。
四、发表时间
在线发表:2024年1月29日
链接:https://doi.org/10.1038/s41929-023-01103-2

五、摘要
丙二酰辅酶A是脂肪酸、聚酮体、黄酮类等众多天然产物的关键前体。天然合成途径依赖乙酰辅酶A羧化酶,存在动力学缓慢、碳损失、ATP消耗及严格调控等问题。本研究设计并实现了一种非羧化丙二酰辅酶A合成途径,以3-氧代丙酸酯为中间体,通过β-丙氨酸-丙酮酸转氨酶与丙二酰辅酶A还原酶催化,实现了高效、无碳损失、无ATP消耗的丙二酰辅酶A合成。该途径在大肠杆菌、链霉菌等微生物中成功应用,显著提升了短链脂肪酸、酚类、醌类、烯烃及大环内酯类等丙二酰辅酶A衍生物的产量,为高效生物制造提供了新策略。
六、研究背景
丙二酰辅酶A是细胞代谢中的核心分子,参与脂肪酸合成、蛋白质丙二酰化修饰,并作为聚酮体、黄酮类、香豆素等超过30,000种天然产物的构建单元。传统合成途径依赖乙酰辅酶A羧化酶,该酶催化效率低(比活性仅为 nmol/min/mg水平),每生成一分子丙二酰辅酶A需消耗一分子ATP,并伴随CO₂释放,碳损失约33%。此外,该途径受长链脂肪酸辅酶A、乙酰辅酶A、ATP/ADP比率等多种因子的严格调控,且其多亚基复合物结构复杂(分子量可达4600–10000 kDa),过度表达常导致细胞毒性。这些局限性严重限制了丙二酰辅酶A及其衍生物的生物合成效率,成为代谢工程中的瓶颈。
尽管通过代谢工程手段如途径过表达或修饰可部分提升产量,但由于天然途径的内在缺陷,效果有限甚至产生负面影响。因此,开发一种结构简单、调控灵活、碳和能量效率高的人工合成途径,成为提升丙二酰辅酶A及其衍生物生产能力的迫切需求。
七、研究结果
结果1、设计与实现NCM形成途径
提出以3-氧代丙酸酯为中间体的非羧化途径,避免天然途径中“脱羧-羧化”步骤带来的碳损失与ATP消耗。
筛选并鉴定出高效酶:β-丙氨酸-丙酮酸转氨酶(BauA)与丙二酰辅酶A还原酶C端片段(MCR-C)。
体外实验中,该途径合成丙二酰辅酶A的速率达2.0 µmol/min/mg,较天然途径提升约10³倍。
结果2、NCM途径避免抑制作用并具有简单结构
不受长链脂肪酸辅酶A、乙酰辅酶A、ADP/ATP比率等天然途径抑制剂的调控影响。
途径仅由两个酶组成(BauA与MCR-C),总分子量约350 kDa,远低于天然PDH-ACC复合物(4,600–10,000 kDa)。
仅需三种辅因子(PLP、NADP⁺、CoA),在多种微生物中含量充足。
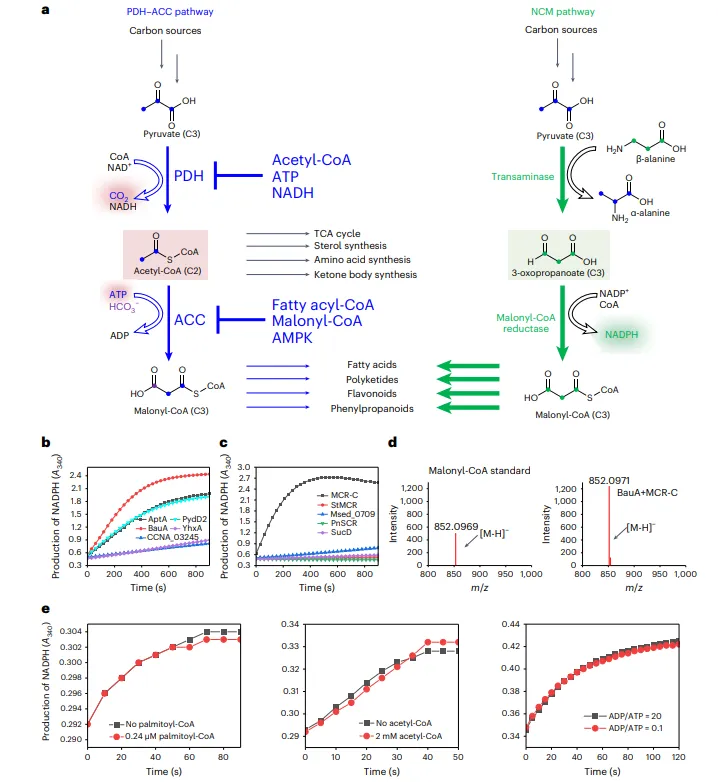
图1 设计人工丙二酰辅酶A途径
结果3、NCM途径的体内实施
在大肠杆菌中引入NCM途径,胞内丙二酰辅酶A含量提升84%。
同位素示踪实验表明,57%的丙二酰辅酶A通过NCM途径合成,显示其在代谢中的显著贡献。
通过CRISPRi抑制天然accBC基因后,细胞生长受阻;引入NCM途径可恢复生长,证明其可替代天然途径。
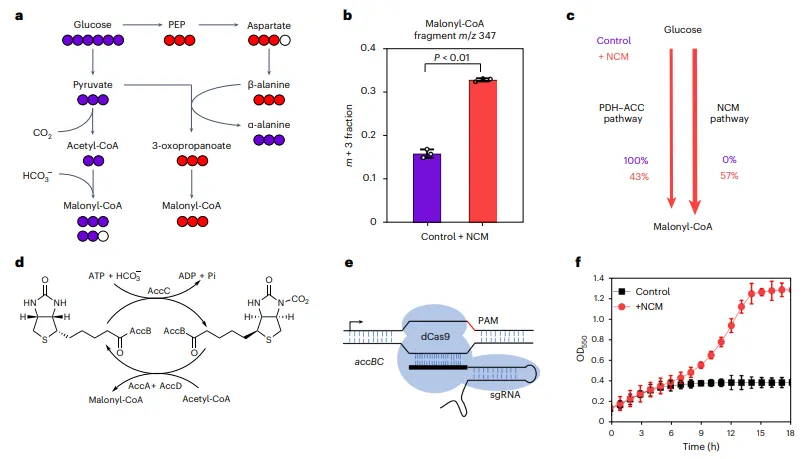
图2 人工NCM途径的体内验证
结果4、NCM途径增强细胞稳健性
表达NCM途径的大肠杆菌对有机酸(如琥珀酸、乳酸)、聚酮体(三乙酸内酯)及高渗透压(NaCl、高糖)具有更强耐受性。
该途径在催化中再生NADPH,提高细胞内NADPH/NADP⁺比率,增强抗氧化能力,从而提升细胞在胁迫环境下的生长能力。
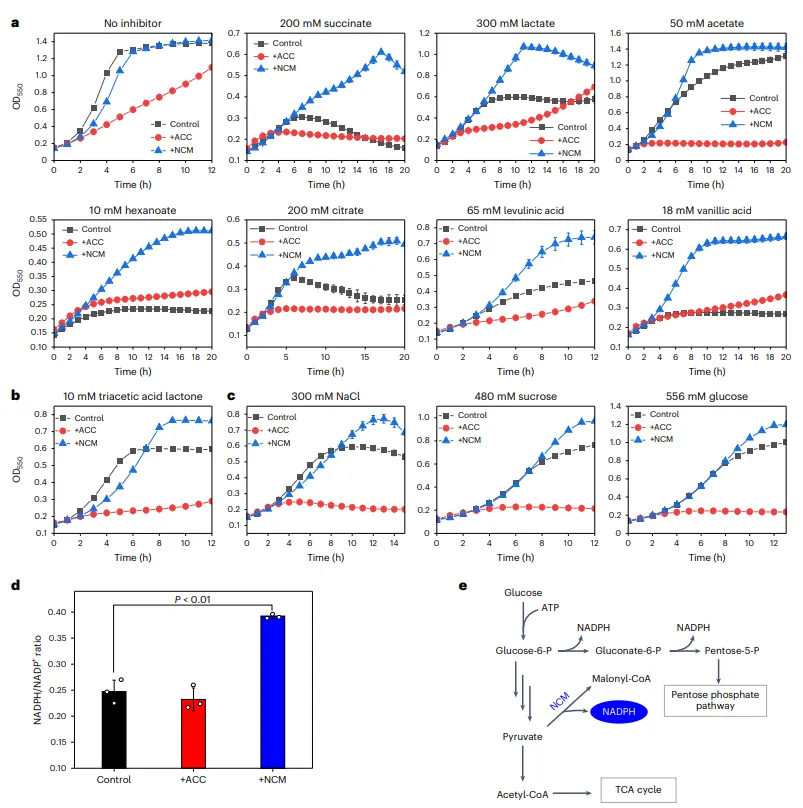
图3 NCM途径的鲁棒性
结果5、利用NCM途径在体内合成MDPs
在多种模型微生物中,NCM途径显著提升短链脂肪酸(辛酸)、酚类(间苯三酚)、醌类(黄霉素)、烯烃类(十五碳七烯)及大环内酯类(纳他霉素、螺旋霉素)的产量。
产量提升幅度在38%至92%之间,显示该途径在促进多种高附加值天然产物合成中的普适性。
细胞内外源添加β-丙氨酸或强化内源合成途径(如过表达PanD或KamA),对产物产量提升有限。
表明在实验条件下,β-丙氨酸供应并非NCM途径的限制因素,其细胞内基础水平已能满足催化需求。
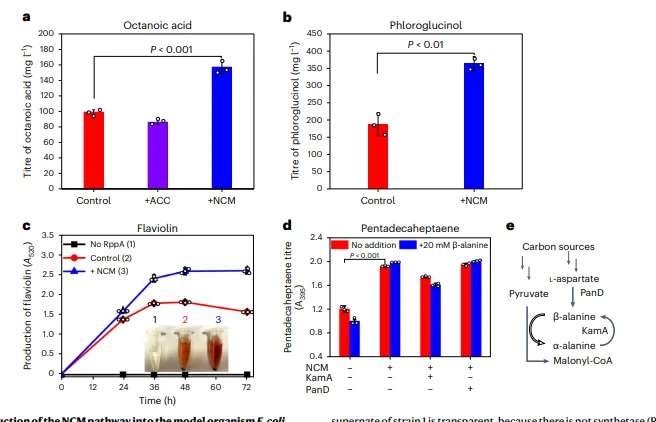
图4 利用NCM途径用于MDP production
结果6、NCM途径的广泛应用
在非模式微生物如链霉菌中成功引入NCM途径,显著提升纳他霉素和螺旋霉素产量。
该途径展现出跨物种、跨产物类型的广泛适用性,为基于丙二酰辅酶A的天然产物高效生物制造提供了通用平台。
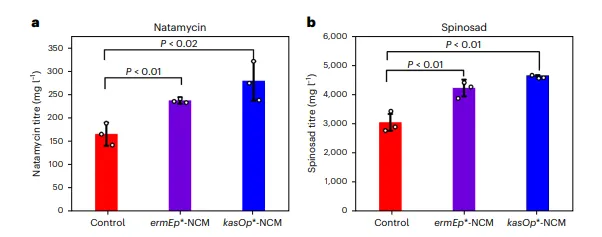
图5 非模式微生物中的应用
八、讨论
本研究成功设计并验证了一种高效、调控简单、结构精简的非羧化丙二酰辅酶A合成途径,突破了天然途径的多种限制。该途径不仅提升丙二酰辅酶A供应,还增强细胞耐受性,促进多种高附加值天然产物的合成。其跨物种适用性显示了在微生物工程中的广泛潜力。未来,该途径有望作为代谢工程通用模块,用于高效生产燃料、精细化学品与药物,并为代谢性疾病治疗提供新靶点。进一步优化发酵条件与途径整合,有望实现更高产量的工业化应用
【近期热文】-生物制造合集
